Validación de Software en Industria Farmacéutica
¿Por qué validar mi Software de Laboratorio? – Validacion de software
Validacion de software para procesos relacionados con la fabricación de productos sanitarios.
En el ámbito los software deben estar sometidos a estrictos y rigurosos controles. Estos controles deben cumplir los principios y guías especificados por las Normas de Correcta Fabricación (NCF).
Como parte del proceso de fabricación de productos sanitarios, se incluyen los controles analíticos que deben realizarse para evaluar la adecuación a las especificaciones técnicas y reglamentarias.
Para documentar dichos controles, cada día es más habitual el registro informatizado de los datos, mediante la implementación de de los conocidos como LIMS, Laboratory Information Management Systems, que permiten:
- Agilizar los tiempos de trabajo en el laboratorio
- Disponer de registros de las actividades realizadas
- Facilitar la extracción y análisis de datos
Las NCF requieren que los software sean validados, principalmente para demostrar que:
- Se dispone de registros trazables y completos de los procesos
- Los datos se mantienen íntegros, y en caso de modificaciones se mantiene registro de los datos originales
- Los registros se encuentran accesibles, al personal autorizado para ello
- Se realizan copias de seguridad periódicas de los datos
- Se dispone de auditoría que aporte información completa de los datos, ej: fecha/hora, responsables, etc.
Fases en la validacion de software
Las NCF establecen para los procesos de validación, una serie de fases. La validación de estas fases debe realizarse de forma secuencial, no pudiendo iniciar una fase, sin haber completado la anterior.
Las fase de validación se recogen en el llamado esquema en “V”, tal y como se recoge en la siguiente imagen:
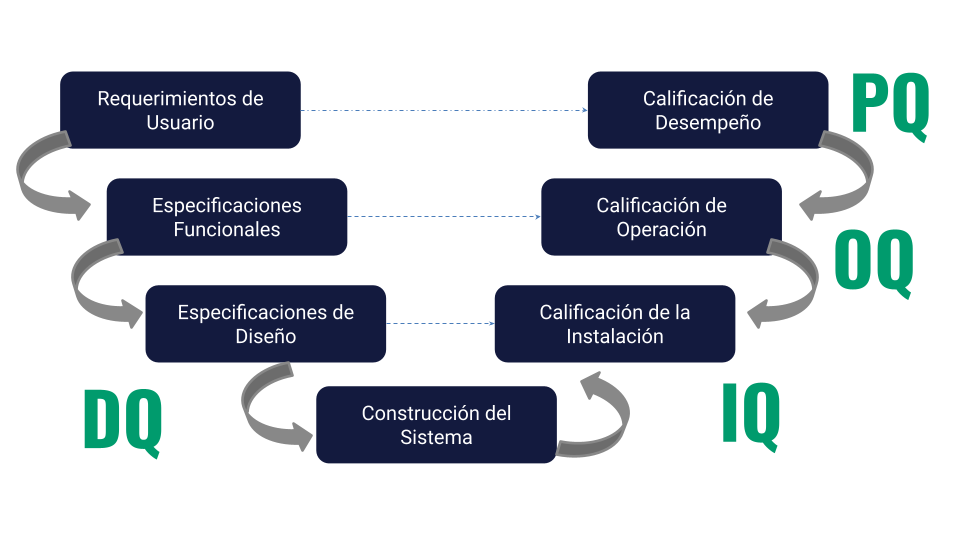
Fase DQ (Design Qualification)
Tiene por objeto comprobar que el LIMS cumple los requisitos establecidos por el usuario. Se realiza previamente a la instalación o alta del sistema.
Fase IQ (Installation Qualitification)
Tiene por objeto comprobar que la instalación o alta del sistema es correcta.
Fase OQ (Operation Qualitification)
Evaluación del desempeño correcto de las funcionalidades individualmente (no proceso). Se incluyen situaciones en condiciones normales y anormales de operación.
Fase PQ (Procedure Qualitification)
Evaluación del desempeño correcto de los procesos clave, estratégico y soporte.
Preguntas Frecuentes
¿Tengo que validar mi software?
Como norma general, se debe validar todo sistema informatizado que tenga impacto sobre las actividades de producción de medicamentos o productos sanitarios y, por tanto, que pueda afectar a:
- la calidad del producto final
- la seguridad del paciente
- la integridad de los datos generados
¿Quién es la entidad responsable de evaluar la validacion de software?
En España, la AEMPS (Agencia Española de Medicamentos y Productos Sanitarios) es la responsable de realizar las inspecciones correspondientes.
¿Qué documentos se generan con la validación?
Disponer de los registros de las actividades de validación que se van realizando resulta imprescindible. Entre los documentos clave cabe destacar: Protocolo (documento que recoge el planning de actividades para la validación), Registros (evidencias de las actividades de validación) e Informe (recoge las conclusiones y resultados de la validación).


